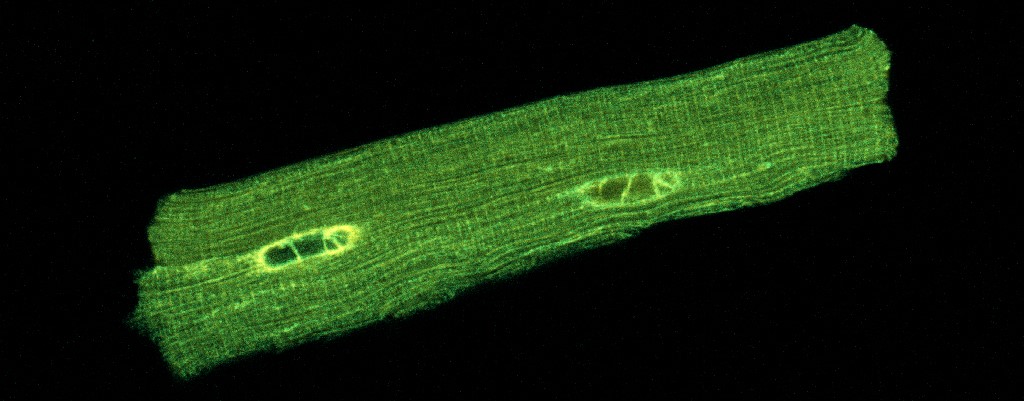
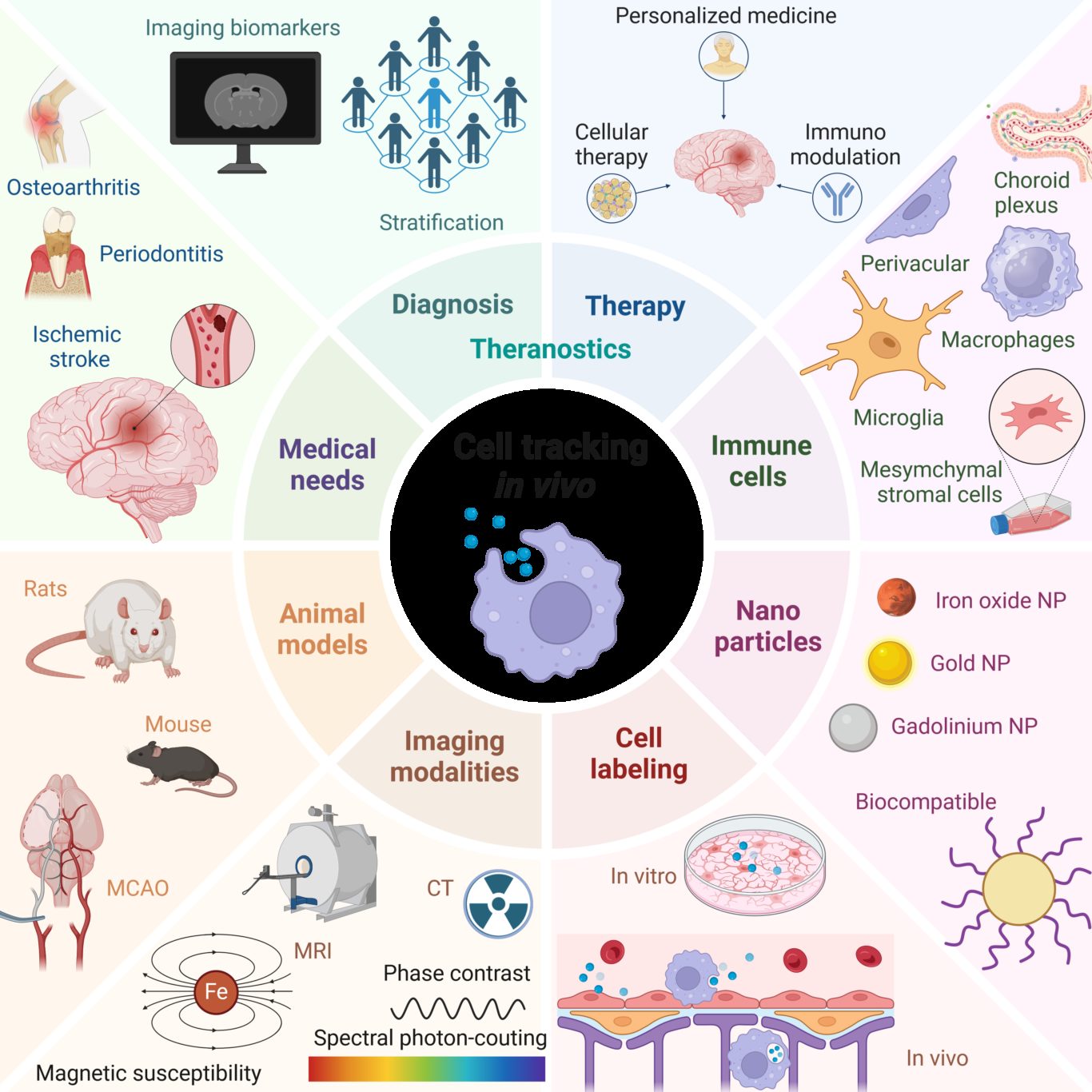
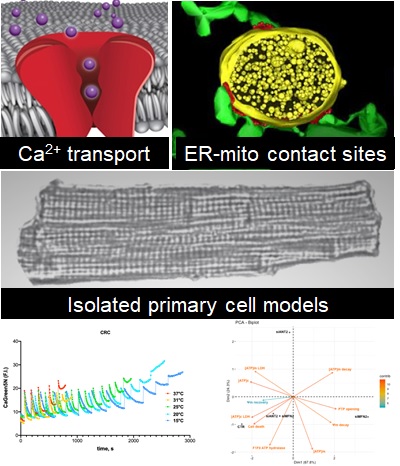
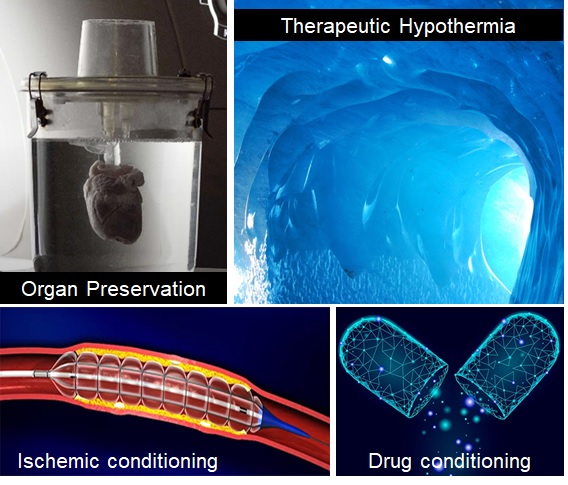
Axe 1 : Imagerie de la mort cellulaire et de l’inflammation
Responsable de l’axe : Marlène Wiart
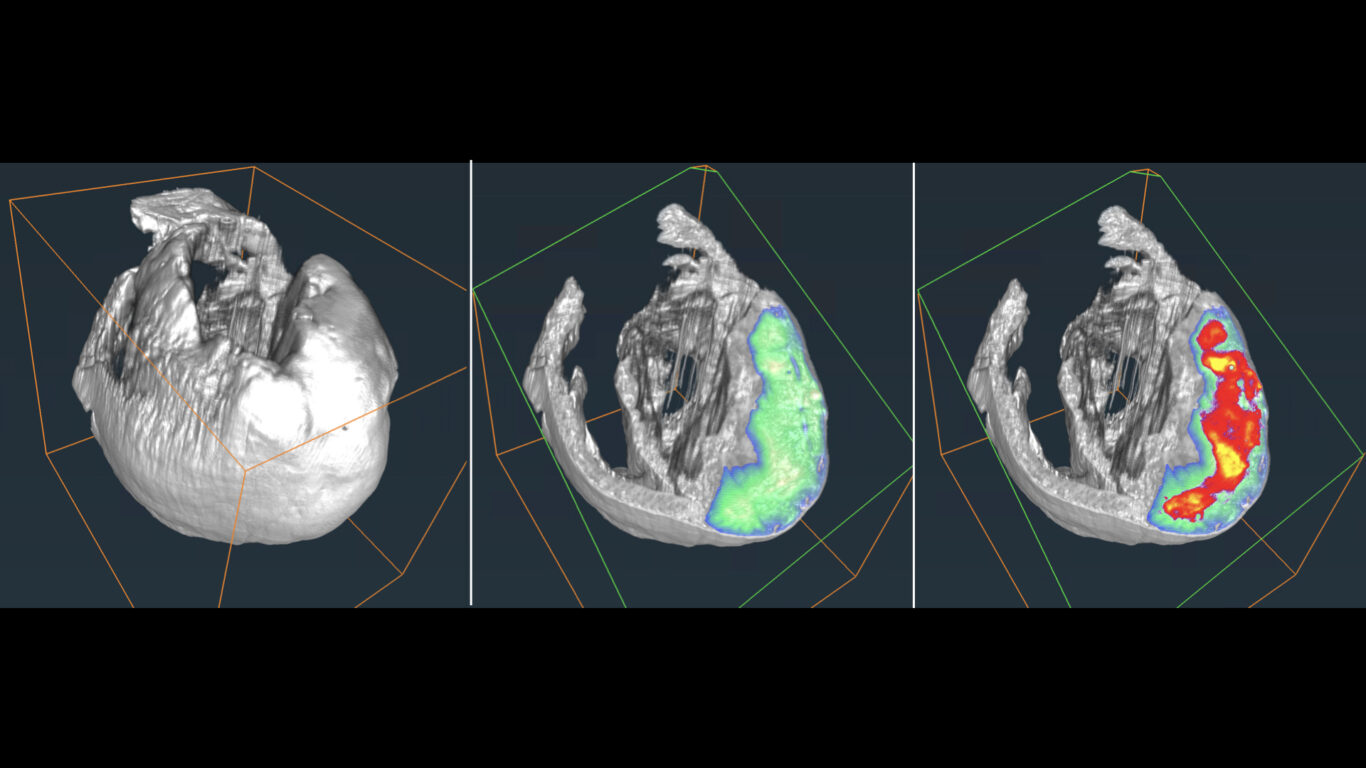
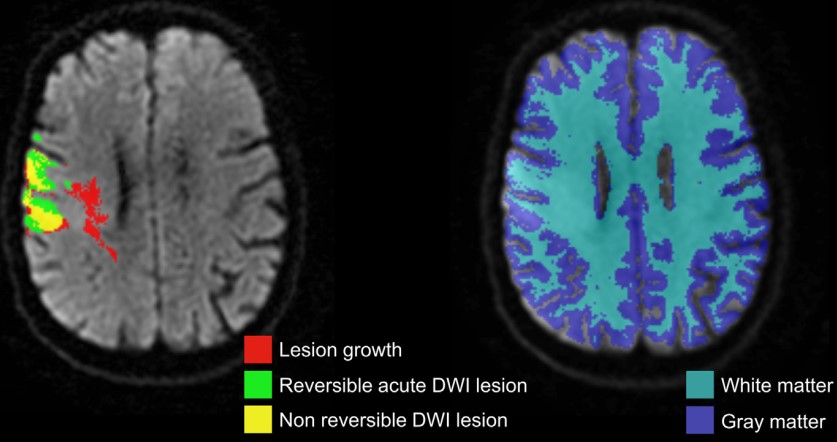
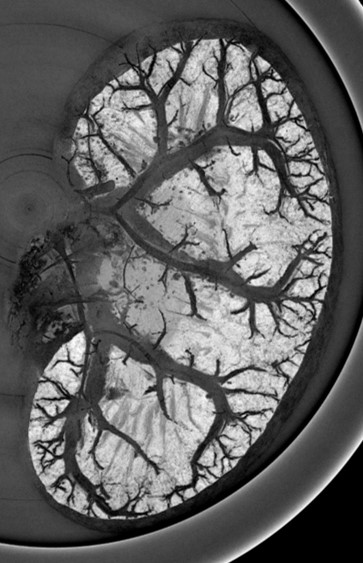
Ces 5 dernières années ont été marquées par une révolution dans la prise en charge des patients présentant un accident vasculaire cérébral ischémique (AVCi), avec l’avènement de la thrombectomie mécanique, en complément de la thrombolyse, pour déboucher les artères. Ce progrès thérapeutique considérable ne doit pas faire oublier le fait que l’AVCi demeure une pathologie très invalidante : seul 45% des patients thrombectomisés sont indépendants dans leur vie courante à 3 mois. De plus, 30 à 50% des patients traités par thrombectomie voient leur état clinique se dégrader de manière non expliquée malgré une revascularisation effective, ce qu’on appelle la « recanalisation futile ». Il existe donc un besoin urgent de thérapies de neuroprotection, afin de protéger le cerveau des dommages de l’ischémie et de la reperfusion. A ce jour, aucune des stratégies de neuroprotection validées au niveau préclinique ne s’est révélée efficace en clinique. Cet échec de la recherche translationnelle s’explique d’une part par une cascade physiopathologique complexe et encore mal comprise, mais aussi par des méthodes précliniques non transposables. Nous proposons de révéler les déterminants des lésions d’ischémie-reperfusion via des outils d’imagerie moléculaire permettant de caractériser et de monitorer les dommages tissulaires chez un même individu de manière longitudinale. Pour cela, nous nous appuyons sur notre expertise en matière d’imagerie multimodale (IRM, PET, CT, échographie) de l’œdème, de la perfusion, du métabolisme et de l’inflammation, en particulier l’imagerie du macrophage et de la dysfonction de la barrière hémato-encéphalique. L’enjeu est de mieux évaluer et de mieux sélectionner les traitements de neuroprotection susceptibles de passer la barre des essais cliniques, par la mise en œuvre d’une méthodologie robuste et translationnelle. Le développement d’outils d’imagerie compagnons (diagnostiques et théranostiques), et la validation des biomarqueurs d’imagerie associés, devrait faciliter le transfert clinique de nos découvertes. Ces méthodes d’imagerie pourront également être étendues aux syndromes d’ischémie-reperfusion touchant d’autres organes tels que le rein et le cœur. En conclusion, notre ambition est de contribuer à construire un pont à double sens entre recherches préclinique et clinique via l’imagerie moléculaire in vivo, avec l’espoir, à terme, de favoriser une prise en charge personnalisée des patients.