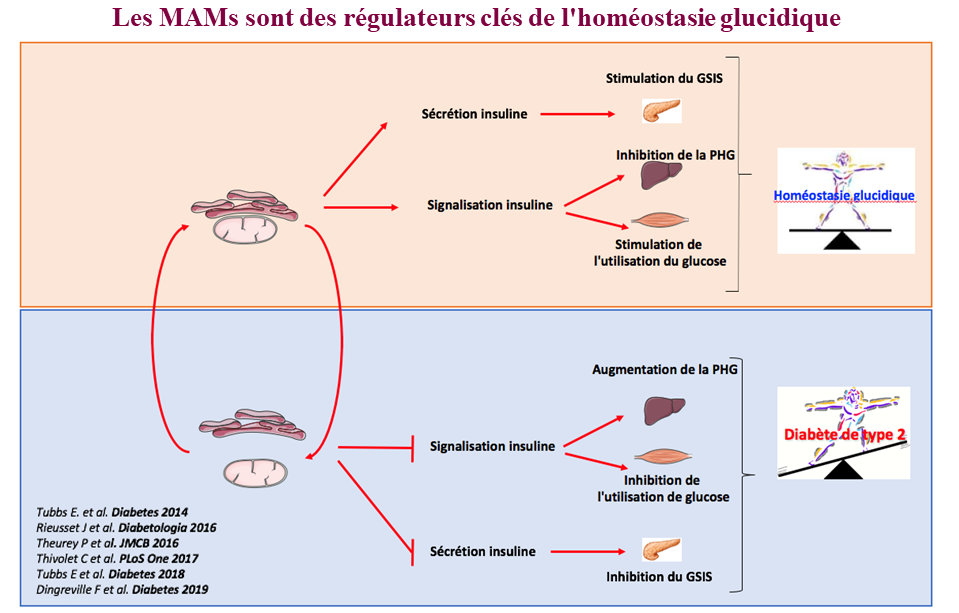
Dans ce contexte, nos travaux pionniers au cours des 5 dernières années ont mis en évidence que les MAMs étaient de nouveaux carrefours de signalisation des nutriments et des hormones jouant un rôle crucial dans la flexibilité métabolique et dans la régulation des métabolismes du glucose et des lipides dans le foie, les muscles squelettiques et les cellules ß du pancréas (Rieusset J, Cell Death Dis 2018; Theurey P & Rieusset J, Trends Endocrinol Metab 2017). De plus, nous avons identifié un défaut de communication entre le RE et la mitochondrie comme un nouveau mécanisme de résistance à l’insuline hépatique et musculaire (Tubbs E et al. Diabetes 2014; Tubbs E et al Diabetes 2018) et de dysfonctionnement des cellules ß pancréatiques en situation de glucotoxicité (Dingreville F et al. Diabetes 2019), faisant des MAMs un acteur clé de l’homéostasie glucidique. Ces données ont été en partie confirmées chez l’homme (Tubbs E et al. Diabetes 2018, Thivolet C PLoS 2017). Par conséquent, cibler les MAMs pourrait constituer une stratégie intéressante pour améliorer l’action et la sécrétion de l’insuline et améliorer l’homéostasie du glucose au cours du DT2. Les MAMs pourraient également contrôler le métabolisme lipidique (Bassot A et al. Biochim Biophys Acta Mol Cell Biol Lipids 2021) et un défaut de communication entre ces deux organites pourrait être impliqué dans la physiopathologie des NAFLDs et dyslipidémies.
Équipe MERISM : « Interactions mitochondrie-RE et signalisation dans la santé et les maladies métaboliques »
Objectifs de l'équipe
Les sites de contact entre le RE et la mitochondrie, appelés MAMs, ont récemment émergés comme des régulateurs clés de la bioénergétique des mitochondries et de plusieurs voies de signalisation, permettant aux cellules d’adapter leur métabolisme aux changements environnementaux et de maintenir leur homéostasie cellulaire.
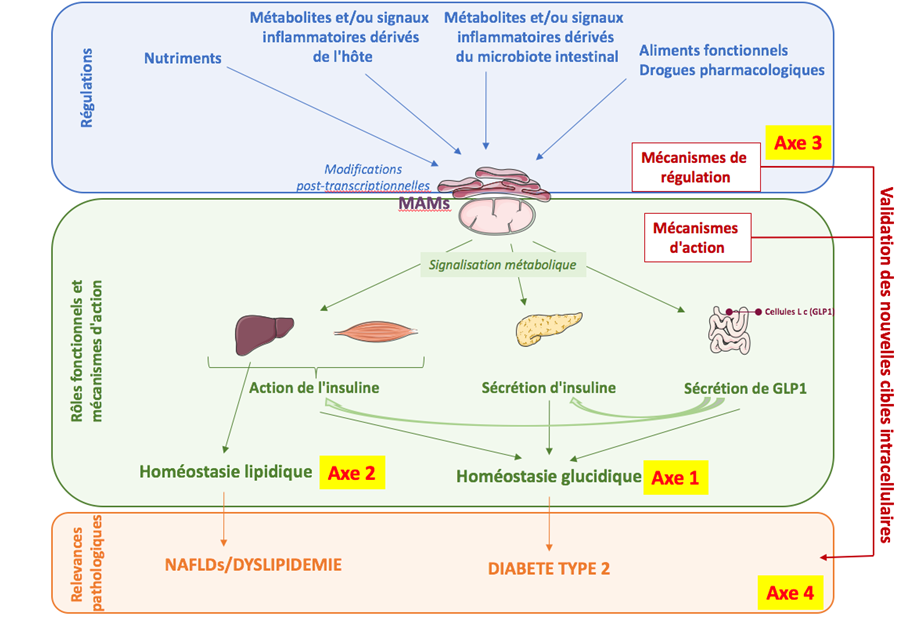
L’objectif général de notre programme de recherche est de mieux caractériser les rôles fonctionnels des MAMs dans le contrôle de l’homéostasie du glucose et des lipides et d’identifier de nouveaux acteurs ou régulateurs des MAMs, qui pourraient représenter de nouvelles cibles pour améliorer les maladies métaboliques, en particulier le DT2, les NAFLDs et/ou les dyslipidémies.
Plus spécifiquement, nos objectifs spécifiques seront :
1) De caractériser le rôle physiologique des MAMs dans le contrôle du métabolisme du glucose et des lipides et d’étudier les mécanismes moléculaires sous-jacents.
Outre le rôle des MAMs dans le contrôle de l’action et de la sécrétion d’insuline, nous prévoyons d’étudier un nouveau rôle des MAMs dans la sécrétion de GLP1 induite par les nutriments dans les cellules L de l’intestin, ainsi que dans l’action du GLP1 dans le foie et le pancréas.
Concernant le métabolisme lipidique, nous souhaitons déterminer si les MAMs impactent le stockage intracellulaire des lipides via un contrôle de la lipogenèse hépatique de novo, de l’oxydation des acides gras mitochondriaux, et/ou de la sécrétion des lipoprotéines. D’autre part, nous souhaitons déterminer si une mauvaise communication entre les deux organites participe à la stéatose hépatique associée aux NAFLDs et à la progression vers la NASH, mais également aux défauts de lipolyse des lipoprotéines riches en TG au cours des dyslipidémies.
Enfin, nous prévoyons de développer et d’utiliser la spectrométrie magnétique nucléaire (RMN) pour caractériser davantage les fonctions métaboliques des MAMs dans le foie et les cellules ß, et analyser leurs altérations dans le T2D et les NAFLDs.
2) D’identifier de nouveaux régulateurs nutritionnels ou pharmacologiques des MAMs et leurs impacts fonctionnels.
Les MAMs étant régulées par certains nutriments (glucose, lipides), nous proposons que des approches nutritionnelles spécifiques pourraient améliorer l’homéostasie glucidique en ciblant les MAMs. Nous souhaitons par conséquent mieux comprendre les régulations physiologiques des MAMs et leur impact sur la flexibilité métabolique du foie et sur l’homéostasie métabolique. Plus particulièrement, nous allons étudier les effets de certains acides aminés, de cytokines pro-inflammatoires et de métabolites bioactifs produits par le microbiote intestinal et altérés au cours des maladies métaboliques. Nous souhaitons également mieux comprendre par quelles modifications post-transcriptionnelles sont régulés dynamiquement les MAMs.
3) De valider les MAM comme cible pour le traitement des maladies métaboliques.
Nous souhaitons valider tous nos concepts chez l’homme en étudiant les MAMs dans les tissus et les cellules mononuclées du sang périphérique (PBMCs) de différents patients. En parallèle, nous réaliserons des criblages de différents aliments fonctionnels (en collaboration avec des industriels) et/ou molécules pharmacologiques, qui seront ensuite validés dans des modèles précliniques d’obésité, de DT2 et de NAFLD, et in fine chez l’homme.
Compétences
- Modèles précliniques murins de DT2 et NAFLD
- Cellules primaires murines et humaines en culture (hépatocytes, myotubes et îlots)
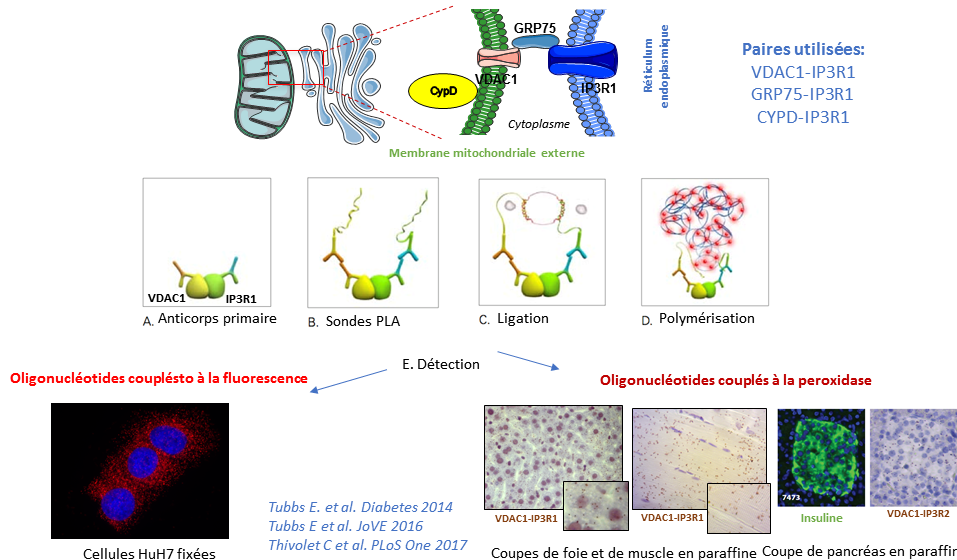
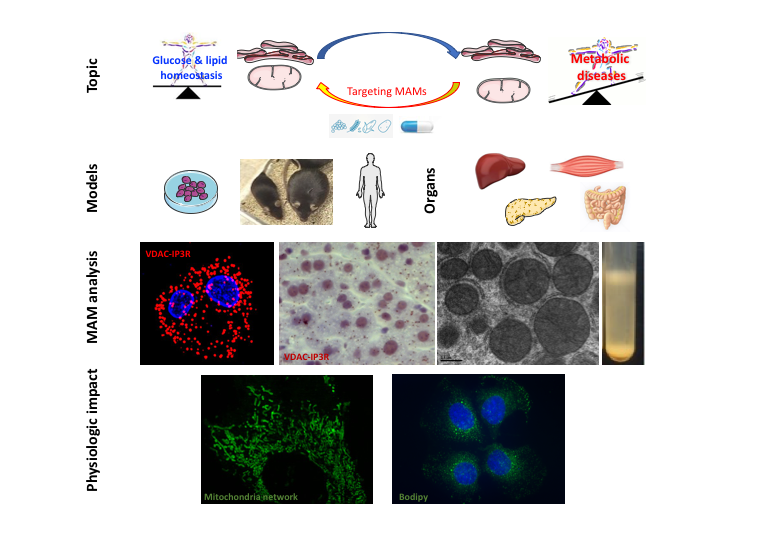
- Analyse structurale des interactions mitochondrie-RE par microscopie électronique, co-immunoprécipitation et fractionnement subcellulaire . En particulier, nous avons développé et validé une nouvelle méthode pour détecter et quantifier les interactions ER-mitochondries par in situ Proximity ligation assay (PLA), via la visualisation des interactions VDAC1-IP3R1, Grp75-IP3R1 ou CypD-IP3R1 dans des cellules fixées ou des tissus enrobés de paraffine ( Vidéo JoVE).
- Analyse fonctionnelle des interactions mitochondrie-RE par mesure du transfert de calcium du RE à la mitochondrie par microscopie confocale en utilisant des sondes FRET spécifiques de chaque organite
- Modulation des MAMs via des approches adénovirales permettant la surexpression de spacer (FATE1, fourni par E Lalli, France)) et linker (fourni par G. Hadjnokzky, USA)
- Analyse de l’action et de la sécrétion d’insuline
- Analyse protéomique et lipidomique
- Forte complémentarité entre la recherche fondamentale et les investigations cliniques favorisant la recherche translationnelle
Les ressources biologiques
- Tissus provenant de souris obèses et diabétiques
- Cellules primaires murines et humaines en culture (hépatocytes, myotubes et îlots)
- Fractions de mitochondries, RE et de MAM de foie et de muscle squelettique provenant de souris obèses et diabétiques
- Sections de pancréas humain (réseau nPOD)
- Sections de foie humain

